








Категория: Инструкции
Образцы изготовлены в виде сухих фиксаналов (таблеток), после растворения которых в соответствии с инструкцией по применению обеспечивается следующая концентрация указанных соединений:
ГСО 7283 – 96 раствора анионных ПАВ - 100 мг/дм3;
ГСО 7281 – 96 раствора нитрат-ионов - 100 мг/дм3(по азоту);
ГСО 7279 – 96 раствора сульфат-ионов - 500 мг/дм3;
ГСО 7278 – 96 раствора формиат-ионов - 66 мг/дм3;
ГСО 7280 – 96 раствора хлорид-ионов - 1000 мг/дм3;
ГСО 7282 – 96 раствора нитрит-ионов - 100 мг/дм3.
Объем растворов вышеуказанных концентраций, приготовленных из одного экземпляра образца - от 500 до 1000 см3, в то время как один экземпляр аналогичных жидких образцов, имеющихся сейчас в продаже, содержит не более 16 см3 раствора.
При необходимости работы с более низкими значениями концентрации аттестованных компонентов допускается разбавление растворов стандартных образцов (СО). Процедура растворения описана в паспорте на СО.
Срок годности СО – 3 года.
Границы относительной погрешности аттестованных значений СО при доверительной вероятности Р = 0,95 не превышают следующих значений:
ГСО 7283 – 96 - 1,3 %
ГСО 7281 – 96 - 1,0 %
ГСО 7279 – 96 - 1,0 %
ГСО 7278 – 96 - 1,2 %
ГСО 7280 – 96 - 0,6 %
ГСО 7282 – 96 - 2,0 %
2.2 Подготовка к проведению анализов и приготовление серии стандартных растворов
Для приготовления серии стандартных растворов использовали государственные стандартные образцы состава водного раствора ионов металлов.
Подготовка стандартного образца к применению заключалась в приготовлении из него методом объемного разбавления растворов с необходимой массовой концентрацией ионов металла.
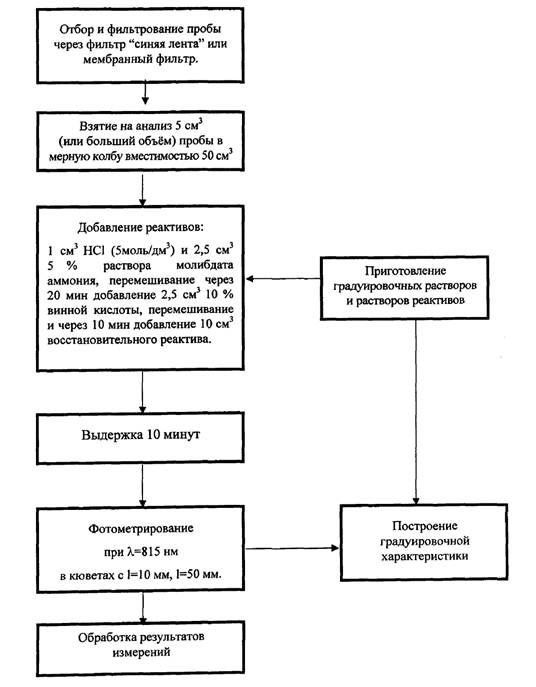
Приготовления растворов проводили по следующей методике:
1. Обмыли снаружи ампулу со стандартным образцом бидистиллированной водой и высушили поверхность ампулы фильтровальной бумагой.
2. Вскрыли ампулу со стандартным образцом с помощью скарификатора и перелили содержимое в чистый сухой химический стакан.
3. Отобрали из химического стакана чистой сухой пипеткой необходимый объём стандартного образца, VСО. см 3. предварительно рассчитав его по формуле:
где C - массовая концентрация ионов металла в приготавливаемом растворе, мг/дм 3 ;
Cm – аттестованное значение массовой концентрации ионов металла в стандартном образце, г/дм 3 .
Vк – объем используемой мерной колбы, см 3 .
Перенесли необходимый объём стандартного образца в мерную колбу, довели объем раствора до метки раствором азотной, либо серной, либо хлороводородной кислоты соответствующей концентрации (в зависимости от состава материала ГСО), колбу закрыли пробкой и тщательно перемешали содержимое колбы [14-20].
Данным методом были приготовлены следующие растворы:
Растворы ионов алюминия с массовыми концентрациями 0,300 мг/дм 3. 0,500 мг/дм 3. 0,750 мг/дм 3. 1,000 мг/дм 3. 1,250 мг/дм 3. 1,500 мг/дм 3. 1,750 мг/дм 3. 2,000 мг/дм 3. 2,250 мг/дм 3. 2,500 мг/дм 3 .
Растворы ионов железа с массовыми концентрациями 0,250 мг/дм 3. 0,500 мг/дм 3. 0,750 мг/дм 3. 1,000 мг/дм 3. 1,250 мг/дм 3. 1,500 мг/дм 3. 1,750 мг/дм 3. 2,000 мг/дм 3. 2,250 мг/дм 3. 2,500 мг/дм 3 .
Растворы ионов меди с массовыми концентрациями 0,050 мг/дм 3. 0,100 мг/дм 3. 0,150 мг/дм 3. 0,200 мг/дм 3. 0,250 мг/дм 3. 0,300 мг/дм 3. 0,350 мг/дм 3. 0,400 мг/дм 3. 0,450 мг/дм 3. 0,500 мг/дм 3 .
Растворы ионов никеля с массовыми концентрациями 0,030 мг/дм 3. 0,050 мг/дм 3. 0,100 мг/дм 3. 0,150 мг/дм 3. 0,250 мг/дм 3. 0,300 мг/дм 3. 0,350 мг/дм 3. 0,400 мг/дм 3. 0,450 мг/дм 3. 0,500 мг/дм 3 .
Растворы из стандартных образцов готовили и использовали при температуре окружающей среды 20?С.
2.3 Отбор и хранение проб
Для отбора проб использовали сосуды из полиэтилена и боросиликатного стекла, предварительно промытые азотной кислотой, а затем ополоснутые водой.
Пипетки и мерные колбы имели 1 класс точности, допустимая погрешность которого представлена в таблице №5.
Таблица №5. Допустимая погрешность мерной лабораторной посуды 1-го класса точности [10].
Номинальная вместимость, см 3
2.4 Приготовление исходных растворов марганца
Навеску металлического марганца 0,5000 г. поместили в термостойкую стеклянную коническую колбу вместимостью 200 см 3. растворили в 50 см 3 раствора 30% азотной кислоты (1:1по объему) при нагревании, затем раствор прокипятили до удаления оксида азота. Охлажденный раствор перенесли в мерную колбу вместимостью 500 см 3. долили бидистиллированной водой до метки и перемешали.
2.5 Определение систематической ошибки приготовления растворов марганца
Концентрацию раствора рассчитывали по формуле:
Далее находили относительную погрешность каждой из величин, входящих в вышеприведенную формулу.
Относительная погрешность концентрации равна:
Абсолютная погрешность концентрации равна [11]:
Результаты представлены в таблице №6.
Таблица №6. Расчет относительной и абсолютной погрешности концентрации раствора марганца.
Величина систематической ошибки приготовления раствора марганца очень мала, поэтому ей можно пренебречь при расчете погрешностей результатов анализа металлических примесей в марганце.
2.6 Методика определения металлических примесей в образцах марганца марки Мн 998 методом атомно-абсорбционной спектрометрии согласно ГОСТ 16698.6-71, ГОСТ 16698.7-71, ГОСТ 16698.9-71, ГОСТ 16698.10-71
Анализируемые растворы и серию градуировочных растворов (в порядке увеличения концентрации) распыляли в пламя горелки и измеряли атомное поглощение (абсорбцию) определяемых элементов по аналитическим линиям с длинами волн, приведенными в таблице №7. После каждого измерения распылительную систему промывали бидистиллированной водой [6]. Для холостого определения использовали бидистиллированную воду.
В данной работе использовали серии градуировочных растворов, приготовленных из водных растворов ГСО.
Условия измерения, представленные в таблице №7, подбирали в соответствии с анализируемым элементом.
Таблица №7. Условия проведения анализа [10].
Резонансная линия, нм
Рекомендуемый диапазон концентраций, мг/дм 3
Слабо восстановительное оксид азота-ацитиленовое
Данная модель атомно-абсорбционного спектрометра позволяет проводить измерения в автоматическом режиме.
Количественный анализ примесей проводили по методу градуировочного графика. Для построения градуировочной зависимости распыляли холостой раствор и серию градуировочных растворов (в порядке увеличения концентрации). Полученные результаты представлены в таблицах № 8, 11, 14, 17. Представленные в выше указанных таблицах результаты были использованы для построения графиков зависимости значения величины абсорбции от концентрации (мг/дм 3 ) металла в стандартных растворах.
Расчет параметров линейного уравнения градуировочной зависимости и их доверительных интервалов проводили по формулам, представленным в работе [8].
Градуировочная зависимость абсорбции от концентрации описывается линейным уравнением:
Используя метод наименьших квадратов коэффициенты уравнения линейной регрессии вычисляли по следующим формулам:
Также были рассчитаны доверительные интервалы для параметров a и b градуировочной зависимости, с применением метода наименьших квадратов.
Дисперсия, характеризующая рассеяние экспериментальных значенийyдляnобразцов сравнения относительно рассчитанной прямойY=ax+b, определяется выражением:
Дисперсии параметров a и b равны:
Из дисперсий были рассчитаны стандартные отклонения и доверительные интервалы для a и b:
Гальванопластика — направление прикладной электрохимии, направленное на создание изделий путем электрохимического осаждения металлов и сплавов на различные носители формы (формообразующие элементы) в жидких средах.
Принцип формирования металлического осадка на поверхности модели, такой же как и при гальваническом нанесении покрытий, но в отличии от классической гальваники (гальваностегии) – толщина формируемых металлических осадков может достигать нескольких сантиметров.
В первой половине 20 века применение гальванопластики с целью получения технических изделий превратилось в полноценную промышленную технологию получения сложных и точных изделий.
Правила построения градуировочного графика при фотометрическом анализеФотометрический анализ при контроле гальванических электролитов применяется для определения малых концентраций добавок и примесей, титриметрический анализ которых затруднён или нецелесообразен.
Распространёнными фотометрическими измерениями являются определения:
• солей хрома III в электролите хромирования и растворе хромитирования,
• общего кобальта и никеля в электролитах твёрдого золочения, серебрения и нанесения сплава «Никель-Кобальт»,
• висмута в электролите нанесения сплава «Олово-Висмут»,
• определение палладия в активаторе для металлизации диэлектриков,
• определение примесей меди, железа и никеля в различных электролитах,
• а также турбидиметрическое определение сульфатов в электролите хромирования и в сульфаматных электролитах для определения степени гидролиза сульфаматов и пр.
Физико-химические методы анализа основаны на взаимосвязи между составом системы и ее физическими и физико-химическими свойствами. Функциональная зависимость между численным значением данного физического или физико-химического свойства и содержанием анализируемого вещества может быть выражена графиком или формулой.

Основой для построения градуировочного графика является приготовление стандартных растворов.
Стандартные растворы необходимо готовить из аттестованных государственных образцов (ГСО). Если таковых не имеется, необходимо четко придерживаться основных требований к точности приготовления стандартных растворов:
• следует применять соединения квалификации не ниже ч.д.а;
• использование реактивов с просроченным сроком годности недопустимо;
• для приготовления стандартных растворов использовать только гостированную мерную посуду.
Особое внимание обратить на условия и сроки хранения растворов с содержанием вещества 1 мг/см3 хранят 1 год, 0,1 мг/см3 – 3 месяца (если нет других указаний, а также если нет помутнения, хлопьев, осадка), растворы с меньшим содержанием применяются свежеприготовленными. Стандартные растворы фильтровать не допускается.
Для определения содержания вещества методом градуировочного графика готовят 3 серии шкал стандартов. Указания по приготовлению шкалы стандартов конкретно оговорены в каждой методике.
При приготовлении параллельных шкал рабочие растворы готовят соответствующим разбавлением основного стандартного раствора, который готовится из одной взятой навески или ГСО.
Градуировочный график строят на миллиметровой бумаге или в электронной форме при помощи Excel, откладывая на оси абсцисс, указанную в методике определения концентрацию, а по оси ординат – измеренные значения оптической плотности.
Количественное значение оптической плотности для каждой точки градуировочного графика определяется как среднее арифметическое результатов параллельных измерений 3-х шкал.
С целью уменьшения погрешности графического измерения, необходимо подобрать такой масштаб графика, чтобы угол его наклона приблизительно равнялся 45º.
Градуировочный график должен нести следующую информацию:
• название определения;
• НД на метод проведения исследования;
• метод определения;
• марка КФК, его заводской номер;
• длина волны;
• длина рабочей грани кюветы;
• раствор сравнения (растворитель, нулевой раствор и т.д.), т.е. относительно чего снимались показания испытуемого раствора;
• дата построения;
• даты поверки;
• на графике должны присутствовать данные 3-х параллельных измерений и среднее арифметическое значение (в виде таблицы).
Градуировочный график строится один раз в год и после ремонта прибора. Поверка графика должна проводиться 1 раз в квартал (если нет других указаний в методике определения), а также после приготовления реактивов из новой партии, поверки прибора. Поверка проводится по 3-м точкам графика наиболее часто встречающихся в работе концентраций. Данные поверки заносятся в журнал поверок градуировочных графиков или наносятся на обратную сторону графика в виде таблицы.
При построении градуировочного графика должна соблюдаться прямая зависимость между оптической плотностью и концентрацией. Прямолинейность графика сохраняется только в интервале концентраций, указанных в методике. Поэтому продлевать градуировочную прямую выше последней указанной в методике точки не допустимо. Находить значение концентраций испытуемого раствора по градуировочному графику ниже первой точки графика не рекомендуется, т.к. это определение несет большую погрешность. В таком случае результат исследования следует записывать в виде "менее. мг/дм3".
Несмотря на простоту и удобство, практическое использование градуировочных графиков в ряде случаев вносит дополнительную погрешность при определении концентрации растворов как за счет субъективного построения графической зависимости, так и за счет несоответствия графичеких (масштабных) погрешностей и погрешностей измерения оптических плотностей. Поэтому для получения более объективных результатов в фотометрическом анализе целесообразно построение градуировочного графика методом регрессивного анализа (уравнение регрессии).
Описание метода наименьших квадратов и пример построение уточнённого градуировочного графика на примере фотометрического определения железа – здесь .
Дополнение для приборов, имеющих стрелочное регистрирующее устройство:
На многих предприятиях до сих пор в эксплуатации находятся приборы, при работе на которых значение измеренного пропускания отсчитывают по стрелочному прибору. Эти устройства являются обычным источником погрешности именно при отсчитывании показаний. Для правильно сконструированного стрелочного прибора погрешность при отсчёте будет постоянной и, возможно, равной толщине стрелки, которая соответствует определённому отсчёту по шкале прибора. При допущении, что отсчёты пропускания, полученные каждым таким устройством, имеют постоянную недостоверность (обусловленную изменением мощности источника света, характеристиками детектора, электрическими шумами, положением кюветы, и обычно приводящую к суммарной погрешности от 0,2 до 1%), можно рассчитать погрешность, которую вызовет ненадёжность при регистрации концентрации определяемых частиц.
Для расчёта концентрационной погрешности необходимо изучить влияние недостоверности измерения пропускания на вычисленное значение концентрации. Для этого запишем закон Бера в форме, которая показывает, что зависимость от концентрации является экспоненциальной:
T = P/P0 = 10-abC, где (1)
b– толщина поглощающего слоя раствора в кювете,
С – концентрация оптически активного вещества,
а – удельная поглощательная способность, зависящая от природы вещества.
Из графика этой зависимости на рисунке можно определить, какое влияние на рассчитанное значение С окажет постоянная погрешность в пропускании.

Сначала рассмотрим спектрофотометрическое измерение раствора с низкой концентрацией (С1) определяемых частиц. Согласно рисунку этот раствор будет иметь высокое значение пропускание (Т1). Допуская, что недостоверность при отсчёте стрелочного прибора соответствует постоянной абсолютной погрешности в Т, можно определить из рисунка результирующую погрешность в определение С. Из экстраполирования линии видно, что абсолютная погрешность в концентрации (ΔС1) мала, когда раствор имеет высокое пропускание. Однако поскольку сама концентрация (С1) мала, относительная погрешность в концентрации (ΔС1/С1) довольно велика.
Теперь рассмотрим случай, когда имеется высокая концентрация (С2) определяемого вещества. Этот раствор будет иметь относительно низкое значение пропускания (Т2). Если снова допустить наличие постоянной погрешности в Т, то получим большую абсолютную погрешность (ΔС2) в концентрации, и хотя концентрация велика, относительная погрешность (ΔС2/С2) также будет велика.
Эти результаты свидетельствуют, что где-то между экстремальными значениями концентрации в пробах, имеющих высокие и низкие пропускания, должно существовать значение пропускания, для которого относительная погрешность в концентрации (ΔС/С) минимальна. В действительности относительная погрешность минимальна при 36,8%-ном пропускании. К этому выводу можно прийти и расчётным путём, вспомнив определение понятия поглощения:
А = lg (1/T) = 1/2,303 ln(1/T) = 0,434 ln (1/T) (2)
Если это уравнение продифференцировать относительно Т, то получим
dA/dT = -0,434/T или dA = (-0,434/T) dT (3)
Для того чтобы оценить относительную погрешность в значении поглощения и тем самым в концентрации, необходимо разделить каждую часть уравнения (3) на поглощение (А). Тогда
dA/А = (-0,434/TА) dT= (0,434/TlgT) dT (4)
Чтобы найти относительную погрешность в концентрации, заменим в этом уравнении А соответствующей величиной согласно закону Ламберта-Бера (1):
d(abC)/abC = (ab)dC/abC = dC/C = (0,434/T lgT) dT (5)
Уравнение (5) показывает, что относительная погрешность в концентрации (dC/C) непосредственно зависит от абсолютной недостоверности в пропускании (dT), а также от обратной величины произведения (TlgT), включающего значение самого пропускания. Графическая зависимость этого уравнения, показывающая относительную погрешность в концентрации (dC/C) как функцию пропускания (в %) при постоянной погрешности в отсчёте (dT), равной 1%, показана на рисунке:

Из рисунка видно, что относительная погрешность в концентрации достаточно низка при пропусканиях между 20 и 70%, но при переходе к очень низким или высоким значениям пропускания погрешность резко возрастает. Можно найти минимальную относительную погрешность в концентрации путём дифференцирования уравнения (5) и приравнивая выражения к нулю. Как указано ранее, минимальная погрешность имеет месть при 36,8%-ном пропускании или при поглощении, равном 0,434. Поэтому для спектрофотометров, имеющих стрелочное регистрирующее устройство, можно проводить измерение с наименьшей погрешностью, если отсчёты по шкале ограничены пределом от 20% до 70% пропускания (или от 0,7 до 0,2 единиц поглощения), а в оптимальном случае эти расчёты приближаются к значениям 36,8% пропускания или к 0,434 единиц поглощения. Обычно можно соблюдать эти ограничения путём соответствующего выбора толщины поглощающего слоя пробы (b) или путём разбавления раствора пробы, взятого для анализа.
Приведённые выше рассуждения применимы только к измерениям на спектрофотометрах, имеющих постоянную погрешность, связанную с отсчётом пропускания. Современные приборы обладают цифровой регистрацией, погрешность отсчёта не является для них фактором, лимитирующим правильность.
1) Переярченко П.В. Афанасьева О.Л. Замковая Л.А. Махоня Т.В. Гольнева Л.Н. Информационное письмо о правилах построения градуировочных графиков при фотоколориметрических методах исследования.
2) Петерс Д. Хайес Дж. Хифтье Г. Химическое разделение и измерение. Теория и практика аналитической химии. – М. «Химия», 1978. – 816 с.
3) Булатов М.И. Малинкин И.П. Практическое руководство по фотометрическим методам анализа, Ленинград, Химия, 1986;
4) Справочник по физико-химическим методам исследования объектов окружающей среды под редакцией Арановича Г.И. Ленинград, Судостроение, 1979;
5) Новиков Ю.В. Ласточкина К.О. Болдина З.Н. Методы исследования качества воды водоемов, Москва, Медицина, 1990;
6) ГОСТ 4212–76 "Реактивы. Методика приготовления растворов для колориметрического, нефелометрического и других видов анализа".
В паспорте на ГСО железа указана концентрация 1 г/л, для графика мне нужно получить раствор концентрацией 0,005 мг/л.
Также в паспорте есть указания, как разбавить ГСО до 10 мг/л (1 мл ГСО в колбу на 100 мл).
Отсюда несколько вопросов:
1. Как из данного раствора (10 мг/л) получить концентрацию 0,005 мг/л? Во сколько раз разбавить?
По моим расчётам нужно разбавить в 10 раз, получим 1 мг/л, затем ещё в 10 раз, получим 0,1 мг/л. Затем в 20 раз.
Верны ли расчёты?
2. В паспорте также указано доводить до метки раствором солянки 0,1 при разведении до 10 мг/л. Если я буду разбавлять несколько раз, нужно все эти разы разбавлять солянкой или дальше нужно дист водой? Это нигде не указано, ни в паспорте, ни в методике анализа.
3. Может ли при неверном разбавлении не идти график? (В плане полного отсутствия реакции, ни одна проба не окрашивается)
Искренне сомневаюсь в том, что концентрация должна быть 0,005 мг/л - это же 5 мкг/л (5 ppb). Редкие приборы с такой низкой концентрацией работают. Даже у АЭС НПО по железу выше. Скорее 0,005 мг/мл, т.е 5 мг/л. Тогда ваши 10 нужно разбавить еще в 2 раза.
13.3.2 Приготовление растворов
13 .3 .2.1 Приготовление 5 % (v/v ) раствора азотной кислоты
13 .3.2.2 Приготовление 1 % (v/v ) раствора азотной кислоты
В мерной колбе вместимостью 1 дм 3 к небольшому количеству бидистиллированной воды прибавляют 10 см 3 концентрированной азотной кислоты, доводят объем до метки бидистиллированной водой и тщательно перемешивают. Срок хранения раствора - 3 месяца при комнатной температуре.
13.3 .2.3 Приготовление
0 ,1 моль/дм 3 раствора соляной кислоты
В мерной колбе вместимостью 1 дм 3 к небольшому количеству бидистиллированной воды прибавляют 8 см 3 концентрированной соляной кислоты, доводят объем до метки бидистиллированной водой и тщательно перемешивают.
При использовании фиксаналов соляной кислоты содержимое ампулы количественно переносят в мерную колбу вместимостью 1 дм 3. доводят до метки бидистиллированной водой и тщательно перемешивают.
Срок хранения раствора - 3 месяца при комнатной температуре.
13 .3.2.4 Приготовление раствора хлористого лантана (спектроскопического буфера для измерения концентрации кальция. магния и стронция )
25 г хлористого лантана (LaCl3 ?7H2 O) растворяют в 50 - 60 см 3 0,1 моль/дм 3 раствора НСl, переносят в мерную колбу вместимостью 100 см 3. доводят до метки 0,1 моль/дм 3 раствором HCl.
В закрытом стеклянном сосуде раствор устойчив в течение 3 месяцев при комнатной температуре.
13.3.2.5 Приготовление градуировочных растворов кальция
10 см 3 раствора кальция (ГСО, 1 мг/см 3 ) с помощью пипетки переносят в мерную колбу вместимостью 100 см 3. Доводят объем до метки 1 % (v /v ) раствором азотной кислоты и перемешивают. Полученный основной градуировочный раствор содержит 100 мг/дм 3 кальция. Срок хранения раствора - 2 месяца при температуре (2 - 10) °С.
5 см 3 основного градуировочного раствора с помощью пипетки переносят в мерную колбу вместимостью 50 см 3 и доводят объем до метки 1 % (v /v ) раствором азотной кислоты. Концентрация кальция в полученном рабочем растворе - 10 мг/дм 3. Срок хранения раствора - 1 месяц при температуре (2 - 10) °С.
Градуировочные растворы кальция готовят в соответствии с таблицей 8, добавляя в мерные колбы вместимостью 50 см 3 по 5 см 3 раствора соли лантана перед доведением объема до метки 1 % (v /v ) раствором азотной кислоты (в том числе для «холостого» раствора). Срок хранения растворов - 1 месяц при температуре (2 - 10) °С или 14 дней при комнатной температуре.
13 .3 .2 .6 Приготовление градуировочных растворов магния
1 см 3 раствора магния (ГСО, 1 мг/см 3 ) с помощью пипетки переносят в мерную колбу вместимостью 100 см 3. Доводят объем до метки 1 % (v /v ) раствором азотной кислоты и перемешивают. Полученный основной градуировочный раствор содержит 10 мг/дм 3 магния. Срок хранения раствора - 1 месяц при температуре (2 - 10) °С.
5 см 3 основного градуировочного раствора с помощью пипетки переносят в мерную колбу вместимостью 50 см 3 и доводят объем до метки 1 % (v /v ) раствором азотной кислоты. Концентрация магния в полученном рабочем растворе 1 мг/дм 3. Срок хранения раствора - 1 месяц при температуре (2 - 10) °С.
Градуировочные растворы магния готовят в соответствии с таблицей 9, добавляя в мерные колбы вместимостью 50 см 3 по 5 см 3 раствора соли лантана перед доведением объема до метки 1 % (v /v ) раствором азотной кислоты (в том числе для «холостого» раствора). Срок хранения растворов - 1 месяц при температуре (2 - 10) °С или 14 дней при комнатной температуре.
Смотри также родственные термины:5.5 Приготовление растворов ионов бората
5.5.1 Приготовление раствора ионов бората массовой концентрации 200 мг/дм 3
Для приготовления раствора в мерную колбу вместимостью 25 см 3 помещают 5 см 3 ГСО состава раствора ионов бората массовой концентрации 1 мг/см 3 и доводят до метки дистиллированной водой. Концентрация бора в данном растворе составляет 36,7 мг/дм 3 .
Раствор пригоден для использования в течение двух недель при хранении в емкости из полиэтилена в нормальных климатических условиях.
5.5.2 Приготовление раствора ионов бората массовой концентрации 20 мг/дм 3
Для приготовления раствора в мерную колбу вместимостью 50 см 3 помещают 5 см 3 раствора бората концентрации 200 мг/дм 3 по 5.5.1 и доводят дистиллированной водой до метки. Концентрация бора в данном растворе составляет 3,67 мг/дм 3 .
Раствор пригоден для использования в течение одной недели при хранении в емкости из полиэтилена в нормальных климатических условиях.
3.6. Приготовление растворов сравнения
3.6.1. Приготовление исходного раствора с массовой концентрацией аммонийного азота 0,5 г/дм 3
(1,910 ± 0,001) г хлористого аммония, высушенного до постоянной массы при температуре 105 °С, помещают в мерную колбу вместимостью 1000 см 3 и растворяют в воде, доводя объем до метки.
Раствор хранят в холодильнике не более 1 мес.
3.6.2. Приготовление серии растворов сравнения
Серию растворов сравнения готовят по ГОСТ 27753.0. Объемы исходного раствора, необходимые для приготовления серии растворов сравнения, указаны в таблице.
Смотреть что такое "Приготовление растворов" в других словарях:Приготовление растворов сравнения — 3.6. Приготовление растворов сравнения 3.6.1. Приготовление исходного раствора с массовой концентрацией аммонийного азота 0,5 г/дм3 (1,910 ± 0,001) г хлористого аммония, высушенного до постоянной массы при температуре 105 °С, помещают в мерную… … Словарь-справочник терминов нормативно-технической документации
Приготовление растворов ионов бората — 5.5 Приготовление растворов ионов бората 5.5.1 Приготовление раствора ионов бората массовой концентрации 200 мг/дм3 Для приготовления раствора в мерную колбу вместимостью 25 см3 помещают 5 см3 ГСО состава раствора ионов бората массовой… … Словарь-справочник терминов нормативно-технической документации
Приготовление рабочих стандартных растворов — 8.1 Приготовление рабочих стандартных растворов Готовят три рабочих раствора, используя стандартные растворы марганца 13,2; 26,42; 39,63 мг Мп/дм3 (6.3). 8.1.1 Пользуясь микропипеткой, вводят 100 мкл бромного раствора в каждую из трех отдельных… … Словарь-справочник терминов нормативно-технической документации
Приготовление буферных растворов для настройки рН-метра — 3.2 Приготовление буферных растворов для настройки рН метра Готовят из стандарт титров. Источник: ГОСТ 26483 85: Почвы. Приготовление солевой вытяжки и определение ее pH по методу ЦИНАО … Словарь-справочник терминов нормативно-технической документации
Приготовление рабочего окрашивающего раствора — 3.2. Приготовление рабочего окрашивающего раствора Запасной окрашивающий раствор разбавляют водой в соотношении 1:9 и растворяют в нем трилон Б из расчета 2 г на 1000 см3 конечного раствора. Раствор готовят в день проведения анализа. 3.3.… … Словарь-справочник терминов нормативно-технической документации
Приготовление стандартны х растворов — 6.4.2. Приготовление стандартны х растворов Аликвоту запасного раствора растворить во взвешенном с точностью до 0,1 г количестве свежей масляной основы с таким расчетом, чтобы получить раствор с заданной концентрацией (например: 0,1; 0,4; 0,6;… … Словарь-справочник терминов нормативно-технической документации
ГОСТ 26483-85: Почвы. Приготовление солевой вытяжки и определение ее pH по методу ЦИНАО — Терминология ГОСТ 26483 85: Почвы. Приготовление солевой вытяжки и определение ее pH по методу ЦИНАО оригинал документа: 4.2. Определение рН Проводят настройку рН метра или иономера по трем буферным растворам с рН 4,01, 6,86 и 9,18. Погружают… … Словарь-справочник терминов нормативно-технической документации
СП 82-101-98: Приготовление и применение растворов строительных — Терминология СП 82 101 98: Приготовление и применение растворов строительных: Водопотребность количество воды, необходимое для получения растворной смеси требуемой подвижности. Определения термина из разных документов: Водопотребность Вязкость… … Словарь-справочник терминов нормативно-технической документации
Вязкость (внутреннее трение) строительных растворов — Вязкость (внутреннее трение) свойство растворов, характеризующее сопротивление действию внешних сил, вызывающих их течение. Источник: ПРИГОТОВЛЕНИЕ И ПРИМЕНЕНИЕ РАСТВОРОВ СТРОИТЕЛЬНЫХ. СП 82 101 98 (утв. письмом Госстроя РФ от 17.06.1998 N АБ… … Официальная терминология
Морозостойкость строительных растворов — Морозостойкость способность растворов выдерживать многократное попеременное замораживание и оттаивание в водонасыщенном состоянии без признаков разрушения. Источник: ПРИГОТОВЛЕНИЕ И ПРИМЕНЕНИЕ РАСТВОРОВ СТРОИТЕЛЬНЫХ. СП 82 101 98 (утв. письмом… … Официальная терминология